
文:王蕾 沈炯
来源:峰瑞资本(ID:freesvc)
1835 年,达尔文登上加拉帕戈斯群岛,开始自己的发现之旅。他采集了大量珍贵的标本,其中就包括群岛上特有的一群雀。它们有相近的喙的结构、短尾、体型和羽毛形状。
1839年,达尔文在《小猎犬号航海记》中写道:“看到如此极小的一群、非常近缘的鸟的结构之渐变和多样化,人们或可想象这个群岛最初没有什么鸟,一个物种被修修改改以满足不同的目的。”
正如那些为了适应环境而不断演化的雀,人类也在与时间的赛跑中不停寻求适应与进化之道。关于衰老的科学探索,就是其中之一。
衰老,作为人类生命进化过程中的伴随产物,已经成为老龄化时代我们必须正视的现实。到 2050 年,全球超过 65 岁的人口将占总人数的六分之一。
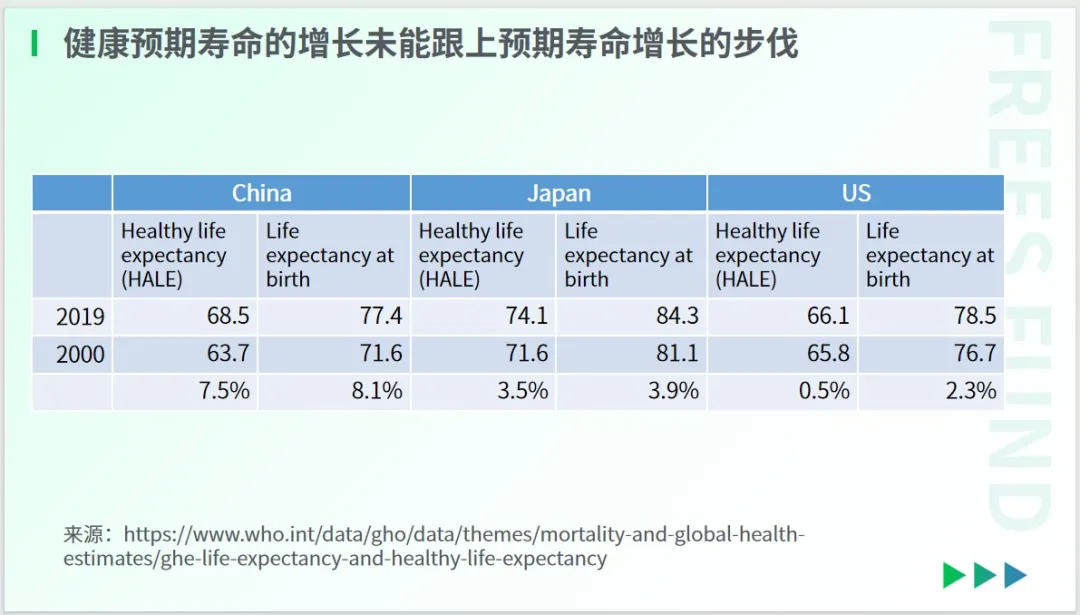
与此同时,人类的“健康寿命”并没有跟上寿命延长的步伐——多数人在六七十岁时,便陷入带病衰老的困境。
因此,抗衰的目标,并非对抗死亡,而是“延长健康寿命”,减少患病、失能的发生。
不过,如何延长健康寿命是个古老、复杂的议题。古时帝王追求仙药,以求长生,今时豪客尝试换血,以续青春。
从早期投资的视角出发,我们始终关注与衰老和老龄化相关的疾病,并持续对相应的解决方案进行投资。
近年来,得益于科学研究的深入和生物技术的突破,很多关于衰老的谜题得以破解。我们也把注意力从老龄化相关的疾病,转移到衰老过程本身,以及那些试图抵抗衰老的创新方法。
医美,在一定程度上可以帮助皮肤抗衰。从传统的“管住嘴迈开腿”到注射司美格鲁肽,是生物科技在体重控制领域发挥神奇作用,而体重控制有助于抗衰。此外,细胞与基因疗法虽面临争议,但也已屹立于抗衰科研的前沿。
在本文中,我们将回到生物世界的第一性原理,探究衰老及与之相关的概念——出生率、寿命。此外,我们系统梳理了与衰老相关的科学和医学进展,以及现实挑战,以期能科学地审视衰老。我们探讨的话题涵盖:
-
生物世界的第一性原理是什么?
-
如何定义衰老?衰老是一种病吗?
-
衰老的标志有哪些?
-
关于抗衰,目前科学和医学分别走到了哪一步?
-
如何科学地抗衰?
-
当我们讨论抗衰的时候,有哪些新语境与新议题?
-
抗衰的未来会是什么样?
我们整理了与抗衰有关的重点书目和论文,已放在文末,供你参考。

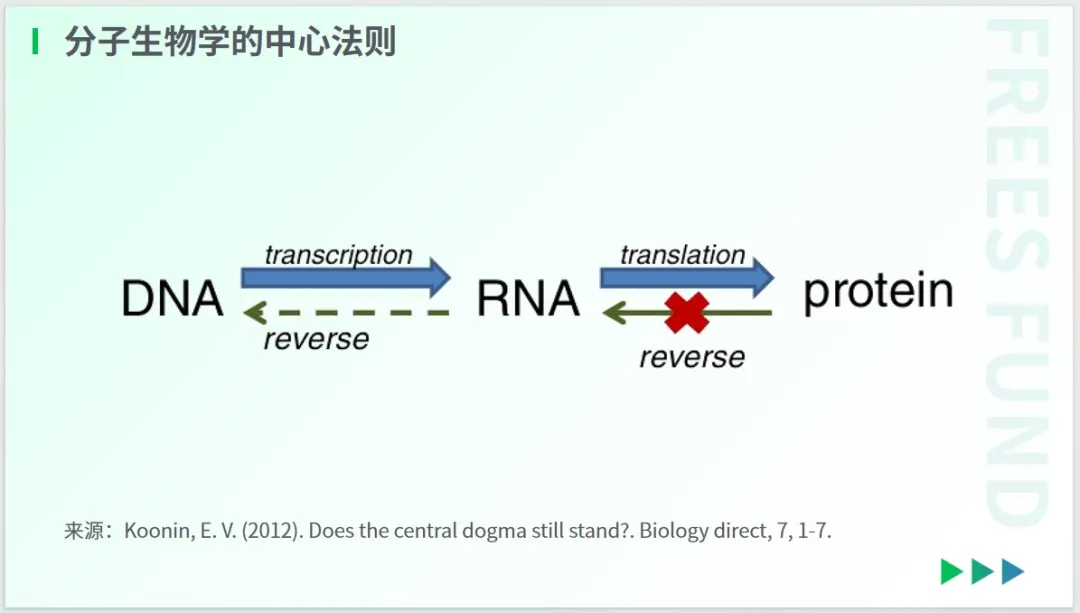
1958 年,佛朗西斯·克里克提出了分子生物学的中心法则,即遗传信息在不同的大分子之间的转移都是单向、不可逆的,只能从 DNA 到 RNA(转录),从 RNA 到蛋白质(翻译)。
这两种形式的信息转移,在所有生物的细胞中都得到了证实。
然而,60 多年后的今天,尽管生物技术高度发达,我们对人体的理解还远不足够,很多事情仍然像是“黑箱”。比如,在创新药的研发过程中,若未经大规模临床试验,几乎无人能预判其安全性与有效性。
与物理世界严密的逻辑规律不同,在生物世界里,我们难以用演绎推理的方法对生物体进行准确预测。
具体而言,即便对于同一物种,即使我们研究发现了细胞的某一条信号通路,也常常无法借此预测或解释其他信号通路的运行逻辑。
那么,生物世界的第一性原理究竟是什么?
这便要回溯到一个经典理论——达尔文的进化论。物竞天择,适者生存。
正如开头所提及的,雀的形态经过漫长岁月的“改良”,才适应了岛上的自然环境。与此同时,哪些帮助雀熬过极端环境的特征会被遗传给下一代。就这样,在“适者生存”的进化法则之下,生命在“有改变的继承”中代代延续。
在生命进化的历程中,死亡是必然产物,而衰老则是生命进化过程的伴随产物,且它与寿命的进程紧密相关。

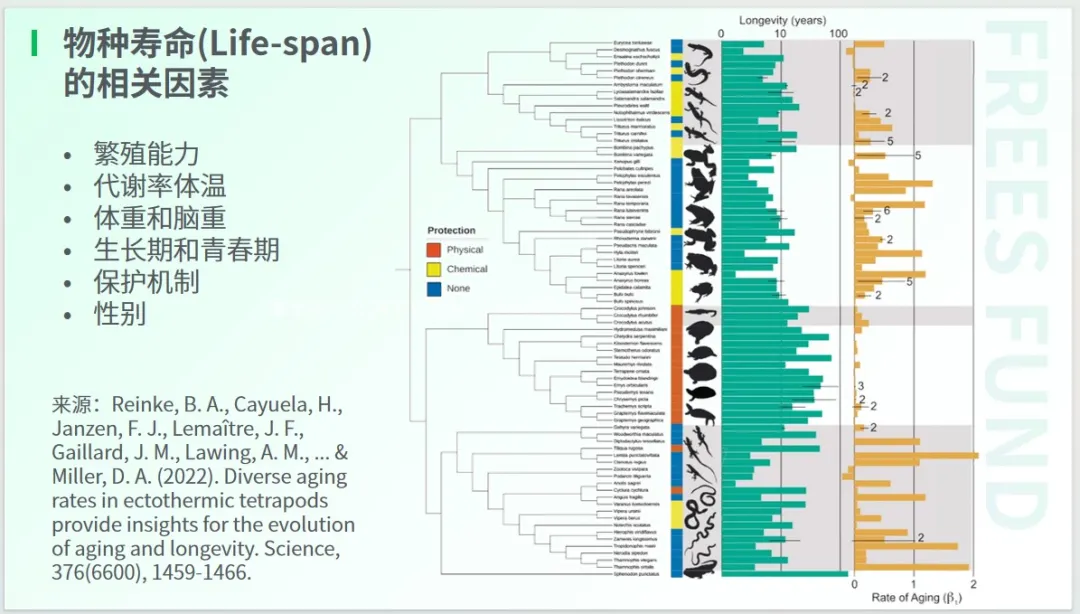
物种的寿命与繁殖能力、代谢率、体温、体重、性别等诸多因素密切相关。
这里有一些有趣的事实:
-
保护机制方面:爬虫动物的寿命长短不一,长则上百年,短则仅数月至一年。研究发现,最长寿的爬虫动物主要有两类,一类是有甲壳的,如乌龟;另一类是有毒液的,以蛇为例,有毒的蛇往往比无毒的蛇寿命更长。
-
性别因素方面:与人类不同,雄性鸟类通常比雌性寿命更长。这是因为鸟类与哺乳动物不同,其雄性拥有两个相同的性染色体。
-
繁殖能力因素方面:经过自然选择或人工筛选后,寿命长的果蝇聚集在一起,繁殖力会下降,而寿命短的果蝇聚集后,繁殖率会提高。这意味着延长寿命的代价是生殖能力的下降。
不过,科学家总结出的这些因素,并不能绝对地代表因果关系,而只是在一个复杂的系统中找到了不同因素的相关性。
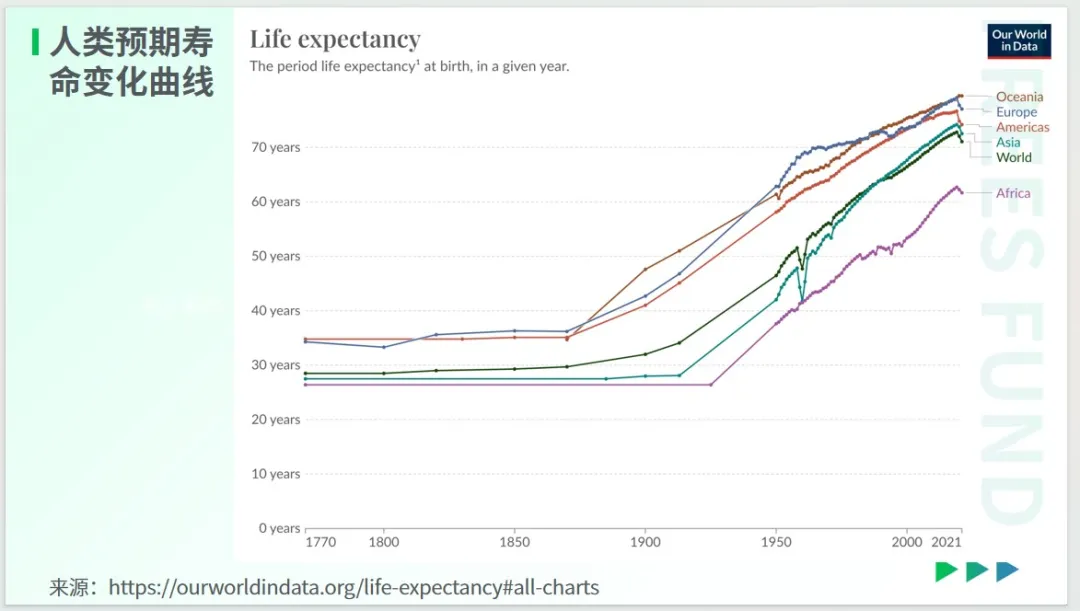
从上面的图表中我们可以看出,人类寿命的大幅提升,始于 20 世纪上半叶,这与公共卫生的进步密切相关。其中,新生儿死亡率的下降,对过去一个世纪人类预期寿命的增长贡献卓著。
具体到不同地区,我们会发现,欧洲人均寿命在 18 世纪时就已超越其他地区,这大致得益于工业革命带来的一些变革。
在这张图表中,加拿大东部出现了偏离值,在欧洲殖民者抵达北美大陆之前,生活在该地的古人就有长寿的记录。即便没有任何科技的加持,他们中的许多人能活到 80 岁,甚至不少人能活到 100 岁。
关于人类寿命的极限,当前主要有两种观点。
其一为性成熟理论,依据统计学推论,人类寿命的极限是性成熟年龄的 8 - 10 倍。由于人的性成熟大致发生在 15 岁左右,因此人类的极限寿命为 120 岁。
另一种说法是海夫利克极限,即细胞分裂的极限为 50 次。体细胞分裂的平均周期为 2.4 年,分裂 50 次,结论同样是 120 岁。

对动物界而言,繁育和传承是进化的主要目标,自然选择通常只作用于那些可提高繁殖成功率的基因。许多动物包括灵长类动物在完成了繁殖之后,或者说失去繁殖能力后,很快就会走向生命的终结。
人类却是个例外。
人类在繁殖期结束后,仍会延续相当长的生命,这段生殖期后寿命(Post-reproductive lifespan,PRLS),即所谓的衰老期。
这意味着,人类的衰老并非自然选择的结果,而是源于人类社会的选择。至于人类为何会如此选择,目前尚无确切解释。
有一种说法认为,衰老期对人类是有益的。这主要体现在两个方面:
其一,人类是社群动物,亲情的照顾有助于整个社群的稳定。在动物界也有类似例证,例如,蜂群中蜂王的寿命特别长,是因为整个蜂群都在照料它,而亲情照顾有利于蜂群的稳定,蜂王的长寿就是这个机制的副产品。
另一方面,在进化上,人和其他动物相比,优势并不在于体力,而是脑力和智力。因为神经元是不会死亡的,理论上,在没有疾病的情况下,一个人的智力认知会随着寿命增长而增长。从这个意义上说,尽可能延长生命,对人类是一种正向的选择。
“衰老”这一专属于人类的社会性概念,也是一个极为年轻的概念。
因为在 200 多年前的 1800 年,人类的平均寿命尚不足 40 岁。饥饿、疾病、杀戮以及各种灾难,使得人类可能尚未进入衰老期便已遭遇死亡。
近几十年来,得益于社会经济、公共卫生、医药保健等领域的发展,以及世界环境的相对和平,人类的预期寿命有了显著提升,我们才有机会目睹越来越多的“衰老”现象。
当老龄化已然成为不可避免的趋势,且“健康寿命”并未跟上寿命延长的步伐,抗衰成为一个重要的议题。尽管在相当长的时间里,关于衰老本身是否是一种病的争论还在继续。
2018 年,世界卫生组织(WHO)曾将衰老纳入疾病范畴,但在其最新的国际疾病分类(ICD - 11)中,衰老被描述为“内在能力的衰退”,却并未明确将其定义为疾病。
WHO 的这种描述,承认了衰老的生物过程,为开发针对衰老的治疗方法提供了基础。当下的共识是,抗衰的目标并非对抗死亡,而是“延长健康寿命”,减少患病和失能的发生。

在历史长河中,人类一直致力于理解和对抗衰老。
古人发明草药疗法和针灸技术,以期促进健康与长寿。此类故事我们都耳熟能详。
自 20 世纪 20年代起,研究者们通过实验证实,动物的寿命是可以调控和影响的。例如,实验结果表明,在不同光照条件下,果蝇的寿命存在显著差异;限制卡路里的摄入,能够延长小鼠和大鼠的寿命。
1950 年代以来,随着遗传学的发展以及生物技术的不断突破,人类对衰老和抗衰的认知逐渐深化。
在时间维度上,人们相信通过增加健康寿命的时长,“衰老期”可以被压缩;在空间层面上,研究者期望通过减少疾病和失能,改变或延缓“衰老”特征,即所谓的“抗衰”。
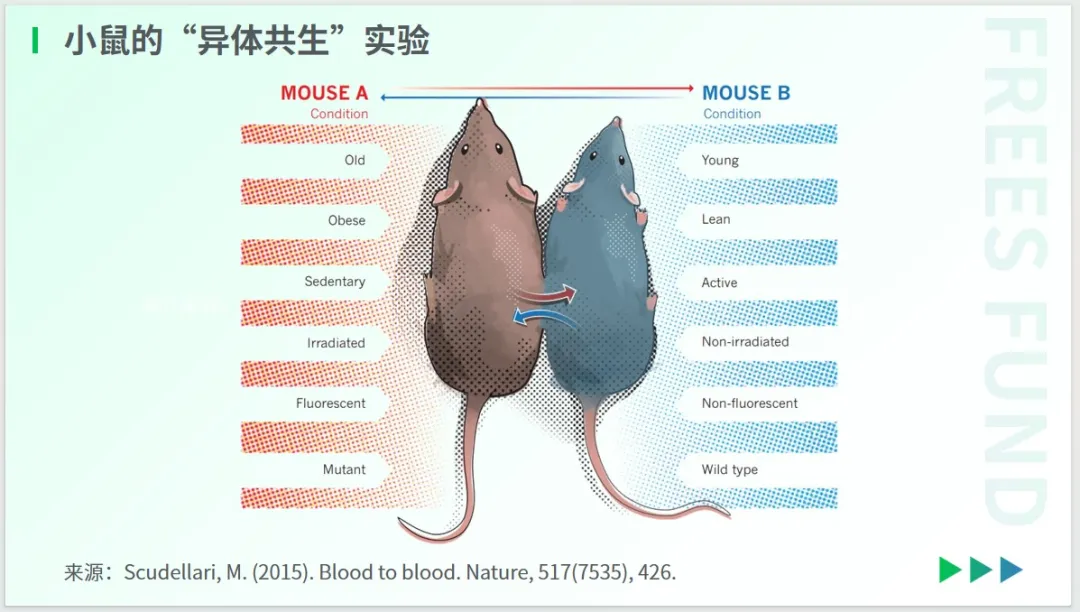
在抗衰领域,“异体共生”实验备受关注——通过人工设计和手术,使两个活体动物(一者年轻,一者年迈)共享血液、器官和环境。
2005年,美国学者Conboy夫妇在《Nature》上发表的研究指出,年轻小鼠的血液能够改善年老小鼠的肌肉和肝脏的再生能力,在一定程度上逆转老年小鼠的衰老迹象。
这项试验激发了后续的大量研究,也相继得到了多次验证。2015年,知名科学记者Megan Scudellari在《Nature》发文说:通过将动物拼接在一起,科学家们已经证明,年轻的血液可以使衰老的组织恢复活力,接下来要做的事情是,测试它是否适用于人类。
总体而言,“异体共生”对人体的生物学年龄和长期健康的总体影响尚不清楚。但为了“返老还童”,总有人愿意尝试。
硅谷富豪布莱恩·约翰逊(Bryan Johnson)的“嗜血”抗衰故事广为人知。曾有一段时间,在加州蒙特里,一家名为 Ambrosia(中文意为“不朽”)的公司诊所内,人们只需支付 8000 美元,便可采用“年轻血液”抗衰老疗法。2017 年播出的美剧《硅谷》第四季中,就出现了“换血抗衰”的剧情。
2019 年,该疗法被 美国食品和药物管理局(FDA) 一纸禁令叫停。即便如此,类似的研究并未停止。
2022 年 8 月,Conboy夫妇在《GeoScience》发表论文称,在人衰老的过程中,体内会积累许多代谢废物,或许我们无需进行“异体共生”,只需将自身体内的血液稀释一半,便可达到“变年轻”的效果。
不过,此次小样本人体试验的结果,能否在未来更大规模的研究中重现,仍有待观察。
总体而言,衰老颇为复杂。人类对“老而不衰”的无尽追求,将继续推动与衰老相关的科学和医学不断向前发展。

那么,衰老究竟是如何发生的?衰老是基因决定的吗?衰老又是从何时开始的?接下来,我们会深入探究衰老的底层机制与理论,以助大家更好地理解衰老的发生过程。
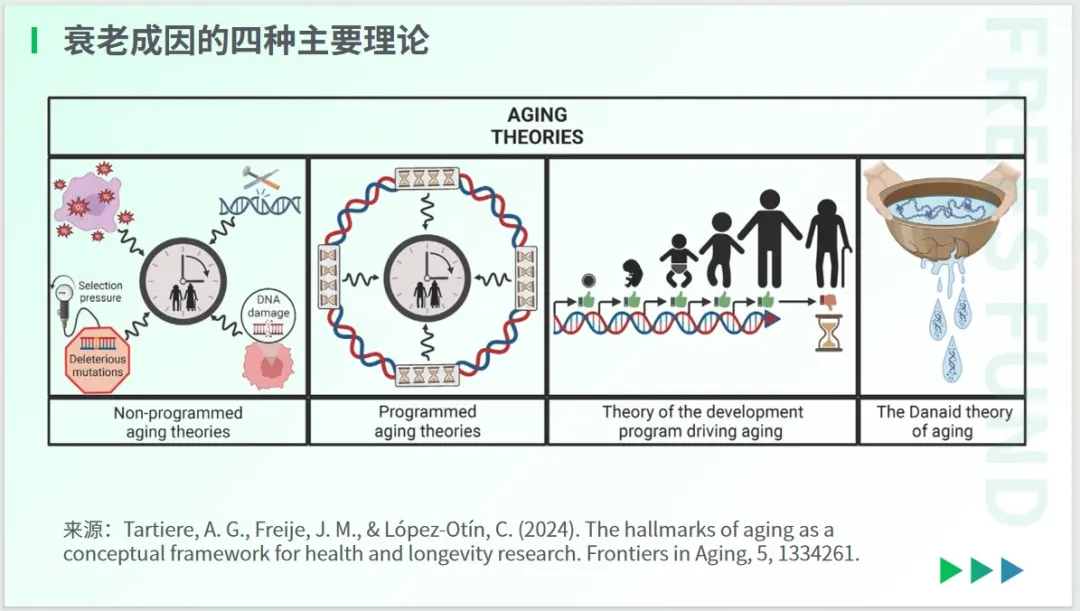
关于衰老的成因,当前学界存在四种理论:非程序性衰老理论、程序性衰老理论、发展程序驱动衰老理论以及达奈德衰老理论。
非程序性衰老理论主张,生命中累积的损伤推动了衰老过程的发生。程序性衰老理论则认为,特定的遗传程序是推动“衰老时钟”的关键因素。
介于这两种观点之间,发育程序驱动衰老理论提出,发育程序的缺陷是导致衰老的主要驱动力。
与之类似,达奈德衰老理论认为,衰老是生物学的固有结果。该理论借用希腊神话中的达奈德(Danaids)来隐喻衰老。在希腊神话中,达奈德因谋杀丈夫而被判处永远用穿孔容器装水。
从这个角度来说,该理论认为生物体就如同穿了孔的容器,其生物学固有的缺陷(孔)使得它无法永远容纳生命(水)。
类比到人类,当最底层的细胞开始出现一个个“洞”时,这些变化会体现在人体的各个器官上,包括皮肤、神经、骨骼等,从而呈现出不同程度的衰老。

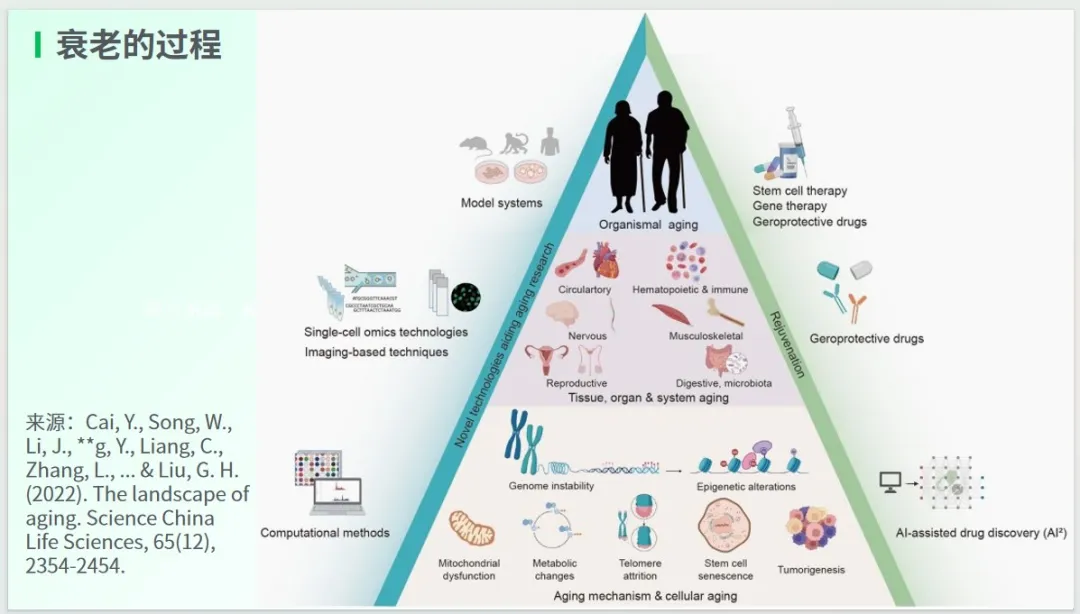
透过下图中的“金字塔”,我们能够清晰地一览衰老过程发生的全景。
在金字塔的最底端,是微观层面的细胞衰老;中间部分,则是中观层面的组织、器官与系统的衰老;而最上面,则是宏观层面的机体衰老。
这与上文所提及的达奈德衰老理论高度契合。衰老就如同在分子和细胞这样的底层出现了一个个“洞”(缺陷),这些缺陷在人体的多个器官上有不同程度的体现,进而引发了不同程度的器官衰老,最终导致整个人的“衰老”。
金字塔的左边展示的是衰老的研究方法,涵盖了生物模型系统、单细胞组学技术、基于成像的技术、生物计算方法等。与之相对应的金字塔右边,则是衰老的治疗方法,包括干细胞治疗、基因治疗、抗衰老药物以及人工智能辅助药物发现等。

回归到最微观的分子和细胞层面,2023 年 1 月,西班牙奥维耶多大学的 Carlos López-Otín 以及法国古斯塔夫鲁西研究所的 Guido Kroemer 等人在《Cell》上发表了一篇题为“Hallmarks of aging: An expanding universe”的综述文章,对衰老的十二大特征进行了定义并予以详细阐述。
作者指出,衰老标志必须满足以下三个标准:(1)会随年龄的增长而发生变化;(2)在实验中增强该特征,有可能加速衰老;以及最为重要的一点(3)通过对该特征进行治疗和干预,有可能减缓、停止甚至逆转衰老。
这 12 个衰老特征包括:基因组稳定性丧失、端粒损耗、表观遗传改变、蛋白稳态丧失、营养感应失调、线粒体功能障碍、细胞衰老、干细胞耗竭、细胞间通讯改变、大自噬功能失效、慢性炎症以及生态失调。
值得一提的是,前 9 个特征是作者在 2013 年就已提出的,而后 3 个则是此次新添加的。
作者还将这些特征分为了三类:原发性、拮抗性、综合性。
衰老的基础标志,即原发性标志,是启动衰老过程的关键。因为它们所产生的损伤会随着年龄的增长而不断累积。
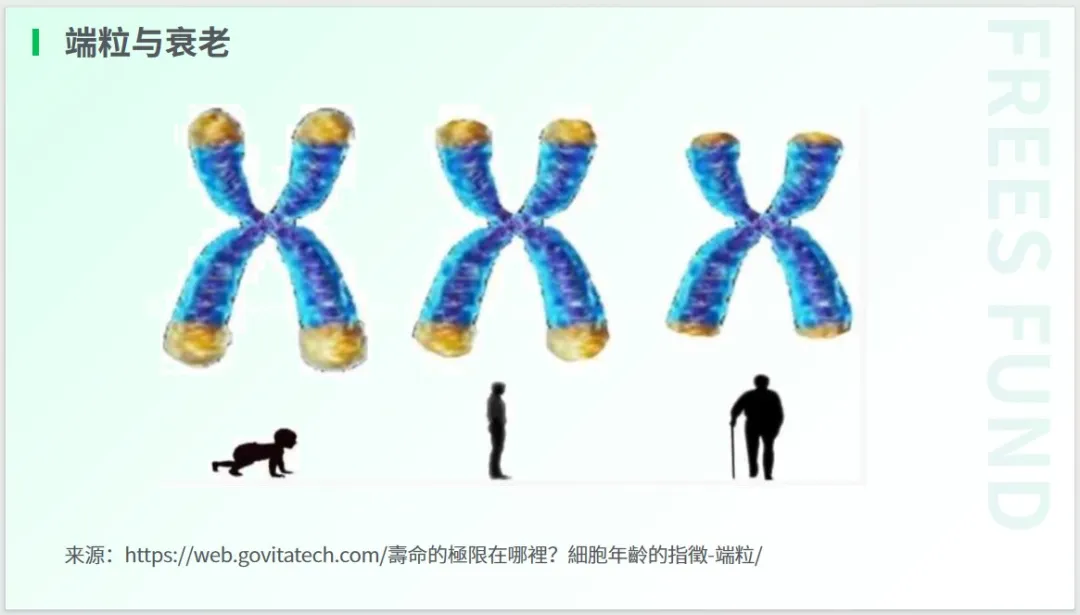
以端粒损耗这一原发性标志为例。研究表明,端粒长度与衰老、人种、分布组织、遗传和变异等诸多因素存在关联。
如前所述,按照海夫利克极限计算,人体细胞大约能够分裂 50 次。随着细胞分裂次数的增加,人类端粒每次会缩短约 40 - 200 个碱基对(bp),因此,在衰老死亡之前,端粒长度通常会剩余一半左右,约为 5 - 6 kb。
2009 年,诺贝尔生理学与医学奖就颁发给了三位研究端粒的科学家,他们因在端粒和端粒酶如何保护染色体方面的发现而获此殊荣。在抗衰领域,我们也可以看到许多研究是从增加端粒长度这一角度入手的。
此外,许多与年龄相关的神经退行性疾病,诸如渐冻症和阿尔茨海默症,都可能与蛋白质稳态受损有关。蛋白质稳态的剧烈扰动,会加速身体的衰老进程。
拮抗性指的是最初对人体有益的机制或通路,随着时间的推移,逐渐变得对人体有害。前面所提及的原发性因素带来的损害逐步累积,也会加剧这一过程。简单来说,年轻时的“蜜糖”,到年老时却成了“毒药”。
以营养感应失调为例。当细胞判断营养素存在与否的机制失效时,营养素感应失调便会发生,从而带来有害影响。
要知道,在人处于发育期时,或者说在极端恶劣的环境中,我们的身体会创造出一种机制来制造营养,以保护细胞免受营养素匮乏的影响,从而使我们得以生存。
因此,有学者提议从能量控制的角度来抗衰,相当于人为营造一个环境,让身体感受到一种类似于人在发育期对营养有渴求的状态,以延缓营养感应失调,保持旺盛的生命力。
类似地,还有研究者提出以适度寒冷来抗衰,因为这样可以激发人年轻时的保护通路,以期达到抗衰的效果。
当原发性和对抗性特征造成的累积损伤无法抑制或修复时,整合标志就会出现,导致干细胞衰竭、细胞间通讯改变。它们共同决定了衰老的速度。

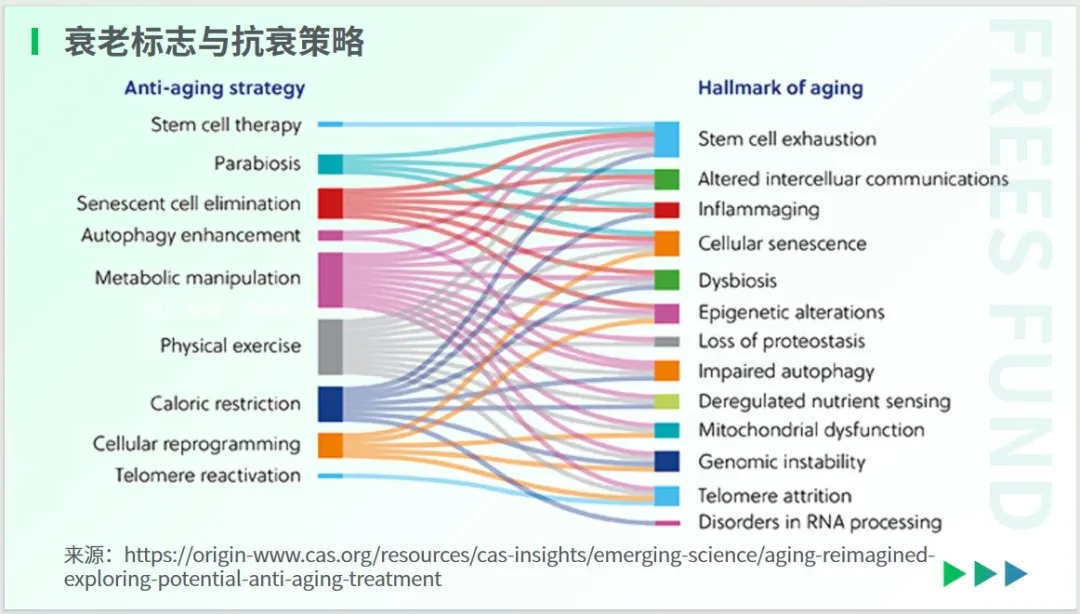
针对上述 12 个衰老标志,研究者们已经展开了许多抗衰策略研究。
从上图可以看出,体育锻炼在细胞层面呈现出较好的抗衰老效果,它几乎与每一个衰老标志都相关联。类似的,卡路里限制也是一种经过深入研究的抗衰老治疗策略,目前有一些临床试验正在进行之中。
干细胞治疗是针对干细胞耗竭而展开的策略。一些靶向药的研发是针对线粒体失调、自噬功能失效等标志展开的。其中一个令人兴奋的药物策略是使用衰老细胞毒素,它们能够选择性地消除衰老细胞的小分子。
这些旨在解决衰老和衰老相关疾病的策略,可以归结为三类:行为干预、保健品与医疗。
在行为干预方面,热量限制、饮食调整、坚持运动、适度寒冷,以及摄入可调节肠道菌群的保健品,这些听起来或许司空见惯的方法,在理论上都被验证对抗衰有益。
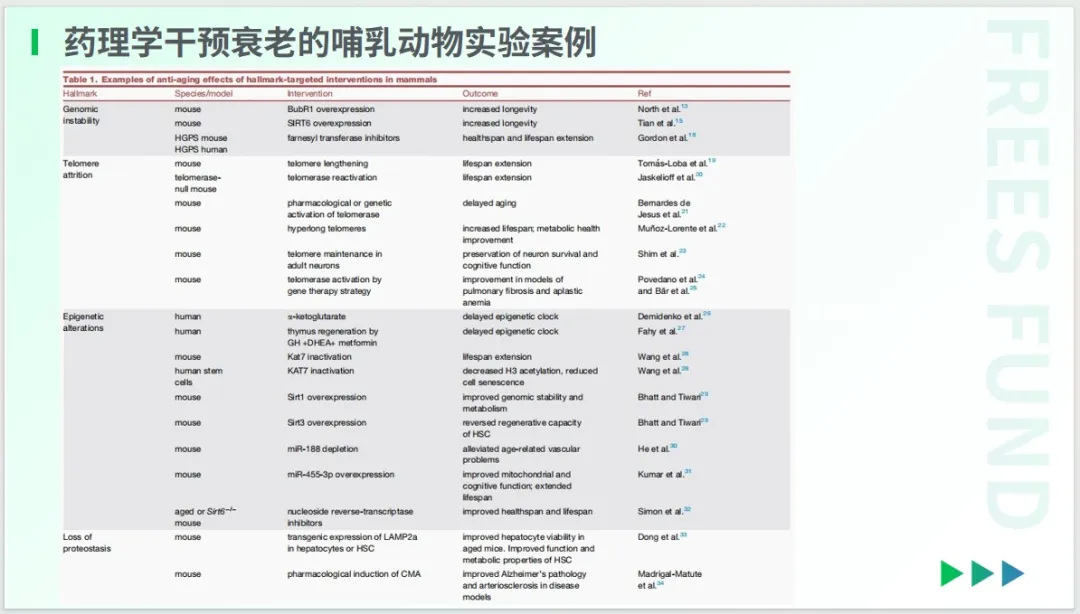
在药理学干预方面,目前有许多动物实验的探索,也已经有不少靶点被验证能够帮助哺乳动物抗衰。
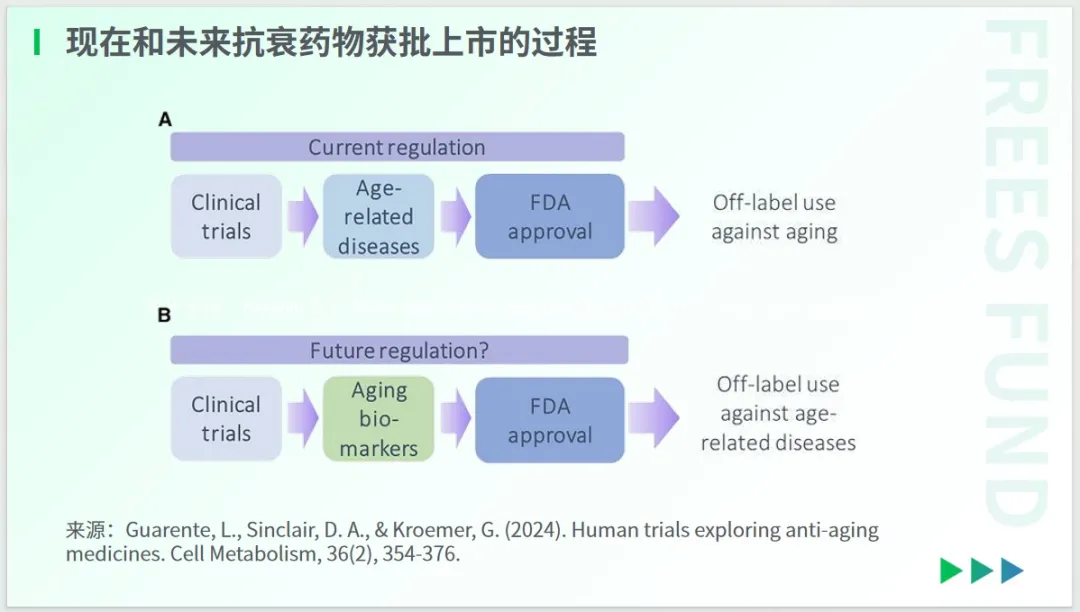
那么,也许你会好奇,为何还没有一款真正意义上的抗衰药呢?这是因为这些在动物实验中被证明具有潜在有效性的研究成果,尚未能够进入正规的人体临床试验。
目前,衰老尚未成为公认的药物开发或治疗目标,第一批评估抗衰老干预措施的临床试验必须是针对预防或减轻与衰老相关的病症,而非衰老本身。
这也从侧面解释了为什么著有《长寿》等畅销书、被誉为哈佛抗衰教父的大卫·辛克莱一度被指卖假药,从而受到科学界的批评。
未来,随着“衰老生物标志物”被接受,针对衰老本身的药物或许能够得到测试和批准,从而用于治疗“衰老”。
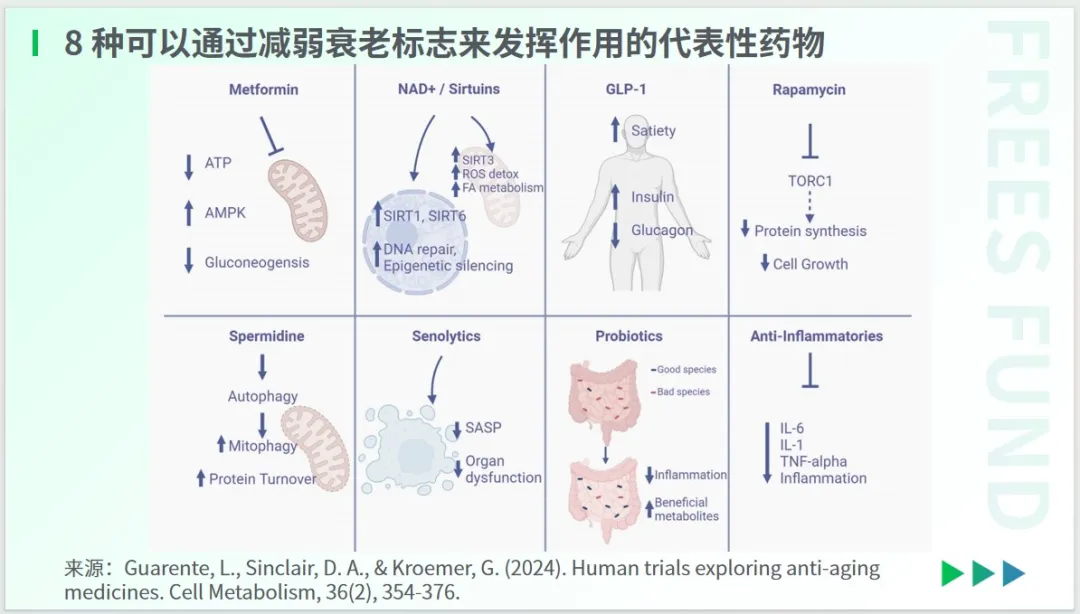
Guarente等学者2024年发表在《Cell Metabolism》上的研究,指出了 8 种可以通过减弱衰老标志来发挥作用的代表性药物,其中包括用于抗肿瘤和改善神经退行性疾病的免疫抑制剂雷帕霉素(Rapamycin)、被验证可以用于降糖和减重的药物GLP-1,以及能促进肠道中有益菌群生长的益生菌,等等。
在这些尚未推向临床试验的药物中,用于治疗 2 型糖尿病的药物二甲双胍是一个特别的存在。一些动物研究和流行病学数据显示,二甲双胍能够延长寿命,并改善健康状况。
2015 年,一项名为“使用二甲双胍靶向衰老”(Targeting Ageing with Metaformin, TAME)的试验成为 FDA 首个批准将衰老作为治疗目标的临床试验。
该试验计划在 3000 名非糖尿病患者(年龄在 65 - 79 岁之间)中进行双盲试验,以研究二甲双胍的抗衰老作用。目前,TAME 研究仍在进行当中,已有初步证据表明二甲双胍在延缓衰老方面具备潜力。

人类社会发展到今天,讨论抗衰,有许多全新的语境。它不仅关乎每一个个体的命运,还和摆在我们眼前的养老难题有关。而且,如果我们将视野进一步拓宽,它还与人类与 AI 共存、太空探索等中长期命题息息相关。
首先我们来看养老的社会负担。到 2050 年,全球超过 65 岁的人口将占总人数的六分之一。衰老阶段所伴随的生理功能下降、患病与失能等问题,使得“衰老”已演变为全球性的经济政策难题。
依据WHO的统计数据,以美国为例,过去 20 年间,美国的人均寿命增长了 2.3%,但其中健康寿命只增长了 0.5%,这表明其“健康寿命”的增长未能与延寿的步伐同步。
与此同时,由于大部分的寿命增长都是处于一种衰老甚至失能状态,这导致美国人均医疗卫生支出居高不下。
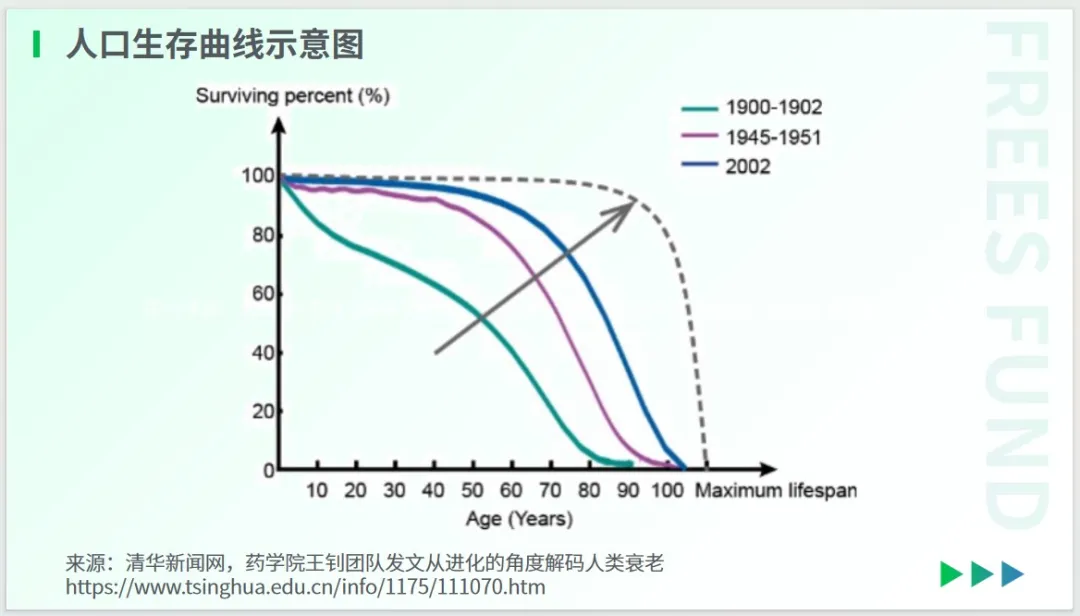
有学者研究指出,使社会和经济负担最小化的方式,是让人口的生存曲线呈现“矩形化”,即让人口的死亡率更集中在极限寿命附近。当然,这只是理论层面的极端设想。
当我们了解了衰老背后的生物学规律,明白人类预期寿命不会骤然缩短后,问题随之而来:伴随老龄化社会而来的种种社会问题,难道真的无药可解?面对养老金缺口难题,究竟是提高生育率还是抗衰老更为有效?
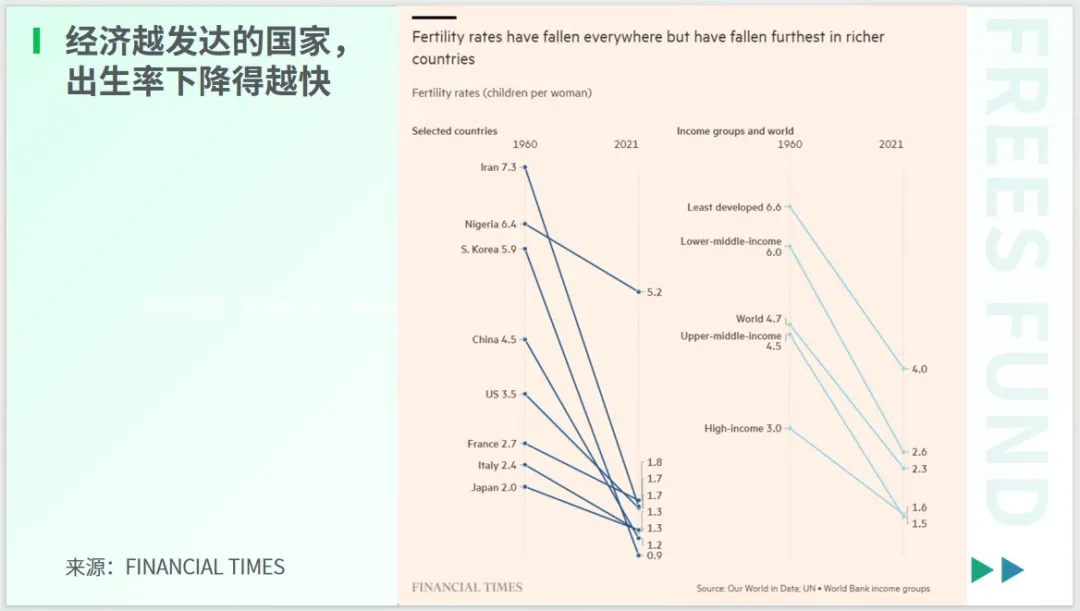
《经济学人》2024 年 5 月的封面文章指出,当前各个国家和经济体都对出生率下降的问题深感担忧。
过去,许多人将其归因于经济越发展,人们越不愿意生育。然而,数据显示,在过去的六十年中,世界上几乎所有国家的出生率都在下降,且经济更为发达的国家,出生率下降的速度更快。
这指向了一个我们较少考虑到的维度——随着人类寿命的延长,人类的出生率必然会下降。
提高生育率与抗衰老,看似是解决方案的“一体两面”。既然我们难以靠提高出生率来打败老龄化,或许“抗衰”才是更为直接有效的办法。换句话说,在人口增长趋缓的时代,通过抗衰延长健康寿命,对推动社会向前发展有积极作用。
再来看人工智能。回望历史,人类的进步与发展高度依赖群体智慧或者说集体智慧。在古代有文字记录之前,信息主要靠口耳相传,老人丰富的阅历和经验对群体的生存极具价值。文字被发明后,信息和知识得以被记录并跨代传播。
在大模型发展进入快车道的背景下,一个值得深入思考的问题是,人类自身的群体智慧能否跟上 AI 的发展步伐,人类如何在与机器人和 AI 共存的时代实现自身价值,追求更高的目标。
研究表明,人类的大脑在一生中都有可塑性和学习能力。
假如能通过有效的抗衰,延长健康寿命,减少脑疾病,将延长人类大脑发挥作用的时长,有助于人类在衰老过程中保持智力活跃,积累新知与智慧,从而为社会向前发展做出更大的贡献。
这类似于 AI 大模型的 Scaling Law(规模效应),即更海量、更高质量的数据输入,会带来更出色的表现。
此外,怀揣“活得更长、活得更好”的期望,也能让我们有机会更好地探索太空。人们往返火星一趟需要 969 天的飞行,而旅行者一号飞了 47 年仍未飞出太阳系。
从这个角度看,在奔向星辰大海的旅途中,我们需要通过有效的抗衰来在时间维度上扩展生命。

“衰老”二字,拆分来看,人们更惧怕的是“衰”而非“老”。当我们谈及“相守一生”时,会说“与子偕老”,却对“衰”避而不谈。倘若我们终将老去,那么我们所追求的应是“老而不衰”。
因此,研究“抗衰”的目的,简而言之,即设法在我们的生命中增加健康寿命的比例,减少患病、失能的寿命。
近年来,与抗衰相关的研究开始获得空前关注,在可预见的未来,这种关注将持续增加。当今科学界对衰老已有较为明确的定义,判断衰老的指标也从 10 年前的 9 个增至 12 个,未来或许还会有新的补充。
尽管那些动物实验存在种种局限,但是它们也能间接地为一些非治疗型的抗衰方向提供指导,如健康饮食、保持运动以及细胞疗法等,这些都值得我们持续关注。
此外,那些原本针对老龄化相关疾病的研究和干预方法,对于抗衰老的指导意义同样重大。
相信未来几年,我们将迎来抗衰行业发展的转折点。届时,可行的策略和方法可能将变得显而易见,并推动我们更广泛地使用干预措施来抵抗衰老。
让我们一起拭目以待。
参考书单
如果你对衰老和抗衰话题感兴趣,可以参考我们整理的“抗衰小书单”。





参考文献
1. Koonin, E. V. (2012). Does the central dogma still stand?. Biology direct, 7, 1-7.
2. Guo, J., Huang, X., Dou, L., Yan, M., Shen, T., Tang, W., & Li, J. (2022). Aging and aging-related diseases: from molecular mechanisms to interventions and treatments. Signal Transduction and Targeted Therapy, 7(1), 391.
3. Conboy, I. M., Conboy, M. J., Wagers, A. J., Girma, E. R., Weissman, I. L., & Rando, T. A. (2005). Rejuvenation of aged progenitor cells by exposure to a young systemic environment. Nature, 433(7027), 760-764.
4. Reinke, B. A., Cayuela, H., Janzen, F. J., Lemaître, J. F., Gaillard, J. M., Lawing, A. M., ... & Miller, D. A. (2022). Diverse aging rates in ectothermic tetrapods provide insights for the evolution of aging and longevity. Science, 376(6600), 1459-1466.
5. Scudellari, M. (2015). Blood to blood. Nature, 517(7535), 426.
6. Tartiere, A. G., Freije, J. M., & López-Otín, C. (2024). The hallmarks of aging as a conceptual framework for health and longevity research. Frontiers in Aging, 5, 1334261.
7. Cai, Y., Song, W., Li, J., **g, Y., Liang, C., Zhang, L., ... & Liu, G. H. (2022). The landscape of aging. Science China Life Sciences, 65(12), 2354-2454.
8. López-Otín, C., Blasco, M. A., Partridge, L., Serrano, M., & Kroemer, G. (2023). Hallmarks of aging: An expanding universe. Cell, 186(2), 243-278.
9. Guarente, L., Sinclair, D. A., & Kroemer, G. (2024). Human trials exploring anti-aging medicines. Cell Metabolism, 36(2), 354-376.
10. López-Otín, C., Pietrocola, F., Roiz-Valle, D., Galluzzi, L., & Kroemer, G. (2023). Meta-hallmarks of aging and cancer. Cell metabolism, 35(1), 12-35.
向上滑动阅览























评论